

栏目分类
发布日期:2024-12-28 03:41 点击次数:165

连年来, 广博药物由于腹黑突发弃世事件而被撤出市集(表 1)[1, 2]。在药物临床前接洽阶段, 24%的药物由于心血管毒反作用辩认建筑, 45%的药物由于引起腹黑毒反作用而撤市[3户外 跳蛋, 4]。药物引起腹黑毒性的主要原因为:阻断腹黑的快速蔓延整流电流(IKr), 形成腹黑动作电位时程中QT间期延长, 进而诱发顶端扭转性室性心动过速(TdP), 严重时可引起已而弃世。IKr由hERG基因编码的Kv11.1钾离子通说念传导, 在所有这个词这个词动作电位时程中起到至关垂危的作用[5], 列国的药物监管部门规则新化学实体必须按照外洋归拢会议(ICH)指南进行全面的hERG活性和QT间期评价。尽早灵验地预测、评价、优化, 幸免药物对hERG钾通说念的遏制活性, 有助于箝制药物建筑的老本, 进步药物建筑的成遵循。
hERG钾通说念是由KCNH2基因编码的4个考虑亚单元所组成的四聚体结构。每个亚单元由α-亚基(6个跨膜结构域S1~S6)和β-亚基(细胞膜内侧N端和C端)组成。主邀功能区α-亚基上的S1~S4结构域是hERG钾通说念的电压传感器, S4链带6个正电荷, 随膜电压的变化在膜内出动, 改革孔说念的绽开与关闭。S5到S6结构域及中间的贯穿区P链上的氨基酸残基(关键氨基酸残基Phe656和Tyr652)组成了hERG钾通说念的中心疏水孔说念, 形似漏斗结构。P链和S6结构域上3个氨基酸残基(Thr623、Ser624和Val625)组成了hERG钾通说念上方的选择性滤膜。hERG钾通说念属于电压门控型离子通说念, 存在3种构象现象, 分离为:关闭态(closed)、绽开态(open)和失活态(inactive), 在动作电位的不同阶段hERG钾通说念绽开、关闭的速率和过程不同, 呈现动态的构象变化[6]。
1.2 药物领导的QT间期延长的可能机制药物引起QT间期延长的作用机制主要分为:①径直遏制hERG钾通说念; ②遏制hERG钾通说念卵白转运。
绝大多数撤市药物均能径直作用于hERG钾通说念, 箝制IKr, 影响心肌动作电位复极化, 进而诱发TdP, 严重时形成已而弃世。临床上主要施展为心电图(ECG)上QT间期延长[7]。大量同源模建和定点突变推行接洽标明:药物中的脂溶性片断或芳杂环简略与疏水性hERG钾通说念中的氨基酸残基Phe656形成π-π疏水作用; 药物分子中的碱性氮原子在生理条款质子化后, 与氨基酸残基Tyr652形成π-阳离子互相作用; 此外, 药物还不错与过滤膜区的氨基酸残基如Thr623、Ser624和Val625产生互相作用[8]。药物在hERG通说念绽开现象干与孔说念, 随后hERG钾通说念立即干与失活现象, 离子孔说念的空间变小, 与药物的结合变强。
此外, 近期接洽标明一些药物还不错通过遏制内质网上hERG钾通说念卵白的转运[9], 减少心肌细胞膜名义hERG钾通说念的抒发, 冷静地箝制IKr, 从而影响腹黑的复极化, 形成QT间期延长。举例:降血脂药物普罗布考[10]、抗抑郁药氟西汀[11]、抗真菌药酮康唑[12]等通过遏制hERG钾通说念卵白转运, 箝制IKr。近来, Wang等[13]接洽标明:细微RNA (miR-17-5p)在慢性氧化应激条款下, 通过靶向多个压力关联的分子伴侣(Hsp70、Hsc70、CANX和Golga2), 遏制hERG钾通说念卵白转运。
1.3 箝制药物hERG腹黑毒性计谋禁受野神思扶助药物瞎想(CADD)预测药物潜在hERG毒性, 领导药物瞎想与更动, 精真金不怕火、快捷且老本较低。接洽东说念主员建筑了许多预测hERG毒性的模子和器用[14, 15]。预测药物hERG毒性模子的构建循序主要分为两类:一类是基于配体的构建循序。如中国药科大学尤启冬等[16]建筑了3D-QSAR药效团和2D-QSAR齐集模子, 标明强效的hERG遏制剂具有肖似高等脂肪胺的药效团模子。中国科学院上海药物接洽所新药瞎想发现中心构建了Bayesian分类模子, 论说了药物遏制hERG钾通说念的活性与化合物的相对分子质地、脂溶性、极性名义积和碱性等性质的关联性, 抽象回归了一系列对hERG钾通说念具有较强遏制活性的药效团片断[17], hERG遏制剂多为脂溶性高、碱性强、缺少氢键受体、柔性较大的分子。另一类是基于受体的预测模子构建循序。由于hERG钾通说念的晶体结构尚未被领会, 接洽东说念主员通过钾通说念的同源模建和分子对接, 接洽药物与hERG钾通说念的互相作用, 并回归抽象hERG钾通说念为疏水型构象多变的离子孔说念[18]; hERG遏制剂与钾通说念氨基酸残基可形成π-π疏水、π-阳离子等互相作用。禁受野心循序预测药物潜在hERG腹黑毒性的优点在于快速、精真金不怕火、从简合成及测试老本。但由于构建模子各样、建模数据库不协调(样本数量、实质测试循序触及配体结合、电生理膜片钳等)、内源hERG钾通说念构象多变的特质, 同源模建和分子对接的精确度也曾现在钾离子通说念接洽的一浩劫点[19]。
现在, 通过先导化合物结构优化处置药物的hERG遏制问题, 也曾改善腹黑毒性最为径直和灵验的计谋。Jamieson[20]、Kerns[21]和You等[22]分离于2006、2008和2011年对箝制药物hERG遏制活性的结构修饰计谋进行了综述。
本文基于前东说念主的责任, 重心综述了2010年之后箝制hERG遏制作用的结构优化计谋, 具体包括:箝制脂溶性、箝制碱性、引入氢键受体或可生成负离子的基团以及构象限制等。本文通过对典型实例分析, 直不雅地反馈了所禁受的化学结构修饰对更动前后药物的理化性质、靶标活性、hERG遏制活性(off-target效应)以及药代性质等多方面的综合影响, 为新药建筑中处置药物潜在的腹黑毒性问题提供一些想路和参考。
2 化学修饰箝制药物hERG腹黑毒性的计谋 2.1 箝制脂溶性Levoin等[23]通过QSAR分析指出分子的脂溶性(clogP、clogD或极性名义积PSA)和芳醇性与hERG遏制活性相关密切。药物分子中的脂溶性芳醇环, 与hERG钾通说念产生π-π疏水作用。箝制分子的脂溶性, 如在药物分子的芳环上引入吸电子基团或者极性基团、或通过电子等排将苯环替换成杂环等, 不错灵验地遏制该疏水作用, 箝制hERG遏制活性。
腺苷受体A2A拮抗剂可用于调理帕金森, 化合物1是默克公司报说念的A2A拮抗剂先导化合物(IC50=5.5 nmol·L-1), 对腺苷受体A1具有较好的选择性, 但具有较强的hERG遏制活性(IC50=1.5 μmol·L-1)。接投箝制脂溶性的计谋[24], 将结尾苯环替换为吡唑获得化合物1a和1b, 脂溶性clogP分离下落1.9和0.7个单元, hERG遏制活性显贵下落(IC50 > 60 μmol·L-1), 同期保合手了化合物对A2A的活性及对A1的选择性(表 2)。
化合物2是广谱的抗菌药物, 抑菌活性较好, 对拓扑异构酶IV具有较强的遏制作用, hERG遏制活性IC50为3 μmol·L-1。将氮杂喹啉等排替换为极性更大的喹诺酮获得化合物2a~2c[25], 脂溶性logD7.4下落0.6~1.6个单元, hERG遏制活性显贵下落(IC50 > 30 μmol·L-1) (表 3)。
加多极性名义积(PSA)和箝制clogP, 不错协同作用箝制脂溶性, 用于改善hERG遏制作用。组胺H3受体拮抗剂3, IC50达到2.4~3.5 nmol·L-1, 但hERG遏制活性较强(IC50=1.1 μmol·L-1), 将结尾苯环替换成二甲基取代的噁唑环[26], clogP和clogD下落0.3~0.4个单元, 同期噁唑环上二甲基取代使得PSA加多近一倍, 化合物3a的脂溶性下落, 其hERG钾通说念的遏制活性显贵箝制(IC50=37 μmol·L-1), 同期对H3受体拮抗活性有所进步(IC50=0.1~0.8 nmol·L-1) (表 4)。
国内2018自拍视频在线将苯环替换为含有氮或氧的脂肪杂环, 如哌啶、哌嗪、四氢吡喃等, 不错灵验地箝制药物分子的脂溶性(clopP), 遏制药物分子与hERG钾通说念的疏水互相作用。化合物4是阿斯利康公司研发的CCR5拮抗剂(IC50=0.32 nmol·L-1), hERG钾通说念遏制活性为7.3 μmol·L-1。在口服给以50 mg·kg-1剂量下, 化合物4在犬模子上引起QT间期延长。接投箝制脂溶性的结构更动计谋[27], 将苯环替换成哌啶或哌嗪, logD7.4下落0.7~1.0个单元, hERG遏制活性大大箝制(IC50=24 μmol·L-1), 同期CCR5拮抗活性保合手(表 5)。
肖似的计谋也被成效利用于H3受体拮抗剂5的结构优化中。化合物5对H3受体的拮抗活性为1.2~16.5 nmol·L-1, hERG遏制活性较强(IC50=0.48 μmol·L-1)。将苯环替换成四氢吡喃环[28], clogP下落2.3个单元, hERG遏制活性降为蓝本的1/39 (IC50=18.9 μmol·L-1), 同期化合物5a对H3受体上的拮抗活性进步(IC50为0.8~1.0 nmol·L-1) (表 6)。
箝制碱性是先导化合物结构优化箝制hERG遏制活性的一个垂危计谋。一些药物分子碱性较强, 在生理条款下可质子化, 同源模建和定点突变推行接洽标明可与hERG钾通说念中的氨基酸残基Tyr652形成较强的π-阳离子互相作用。箝制药物的碱性(pKa), 可遏制该π-阳离子互相作用, 使hERG遏制活性箝制。箝制碱性(pKa)包括:引入吸电子基团(如引入F、磺酰基、杂原子、羰基、酰胺等); 或将氨基替换为酰胺、磺酰胺等。图 1回归了这些计谋关于箝制氨基碱性(pKa)的作用[29]。通过引入极性片断(如羰基和氧杂环等)箝制pKa时, 也会导致脂溶性(logD)的下落, 因此, 箝制碱性和箝制脂溶性互相筹议互相影响。关联词只怕箝制药物分子中氨基的碱性, 会对活性和理化性质形成影响, 因为有些氨基与靶标卵白首生关键的氢键互相作用, 而另一些则当作成盐位点, 用于改善药物的融解性, 此为该循序的一些局限性, 在实质利用中应加以详实。
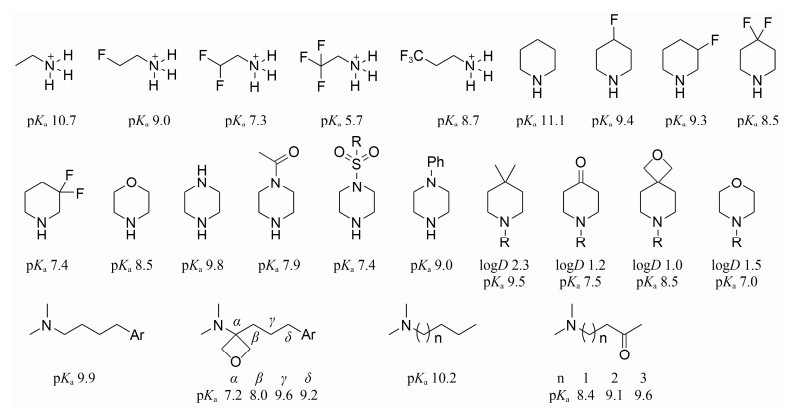 Figure 1 Introduction of withdrawing group to reduce pKa
Figure 1 Introduction of withdrawing group to reduce pKa
广谱抗菌药物化合物6对拓扑异构酶IV具有较好的遏制活性(IC50=3.2 nmol·L-1), hERG遏制活性IC50为44 μmol·L-1, 但在几内亚猪模子上会引起QT间期延长。在哌啶环上引入吸电性的氟原子[30], pKa箝制1.3个单元, hERG遏制活性降至1/5 (IC50=233 μmol·L-1), 同期抗菌活性保合手不变(表 7)。
化合物7是环己基胺类DDP-IV遏制剂(IC50达到0.5 nmol·L-1), hERG遏制活性较强(IC50=4.8 μmol·L-1), 在犬模子上会导致QT间期延长。在环己基环上碱性氨基的β位引入氧原子[31], pKa从8.6箝制为7.3, hERG遏制活性大大箝制(IC50=23 μmol·L-1), 同期对DPP-IV遏制活性不受影响(表 8)。
化合物8是Merck公司建筑的2-氰基嘧啶类组织卵白酶K (CatK)遏制剂, hERG遏制活性IC50为0.16 μmol·L-1。将结构中哌啶替换成氨基酰胺片断[32], 碱性(pKa)和脂溶性(clogP)分离下落1.8和2.2个单元, hERG遏制活性降为蓝本的1/30 (IC50=3.16 μmol·L-1), 大鼠给药化合物8a 100 mg·kg-1两周, 未见腹黑不良反应(表 9)。
将氨基替换成酰胺不错显贵箝制碱性, 改善对hERG钾通说念的遏制活性。化合物9和10是Shin等[33]报说念的一类三级胺类的T-型钙通说念崎岖剂, 是潜在的用于调理心血管疾病的先导化合物, hERG遏制活性较强, 分离为0.18和1.38 μmol·L-1。将氨基替换成酰胺, 碱性和脂溶性均下落, hERG遏制活性IC50分离降为12.5和16.8 μmol·L-1, 但该循序导致钙通说念崎岖活性稍微下落(表 10)。
羟基是一个强极性氢键供体基团, 引入羟基不错显贵地改变分子的理化性质, 箝制脂溶性和碱性, 遏制药物分子与hERG钾通说念的疏水作用和π-阳离子互相作用。连年来, 越来越多的接洽实例确认引入羟基关于改善hERG遏制活性具有垂危作用。
化合物11是玄色素采集激素受体(MCHR)拮抗剂(IC50为13 nmol·L-1), 但hERG遏制活性极强(IC50=0.002 μmol·L-1)。禁受上述箝制脂溶性的计谋, 将苯环替换成四氢吡喃环, hERG遏制活性下落至11的1/60 (IC50=0.12 μmol·L-1), 遏制活性仍较强。在四氢吡喃环上引入羟基[34], hERG遏制活性进一步下落至11的1/4 000 (IC50=8.24 μmol·L-1), 同期MCHR拮抗活性保合手, 可见羟基在改善hERG遏制活性的垂危作用(表 11)。
N-型钙离子通说念(NVDCC)是调理神经难堪的潜在靶点, 化合物12是由Ogiyama等[35]报说念的灵验的N-型钙离子通说念崎岖剂(IC50=0.6 nmol·L-1), hERG遏制活性较强(IC50=8.3 μmol·L−1)。禁受肖似的结构优化计谋, 将2-甲氧基取代的苯环替换成羟基取代的环己基片断, hERG活性下落至98 μmol·L−1 (表 12)。
纺锤体卵白(KSP)遏制剂可用于抗肿瘤。化合物13是Merck公司建筑的KSP遏制剂(IC50=4 nmol·L-1), hERG遏制活性较强(IC50=1.2 μmol·L-1)。在二氢吡咯2-位引入羟甲基获得化合物13a, logP从2.5降到1.7, hERG遏制活性下落到蓝本的1/12 (IC50=14.6 μmol·L-1), 但化合物13a多药耐药性比值(MDR)较高, 易被细胞外排, 通过改革侧链在氨基哌啶引入氟原子, pKa下落1.2~2.2个单元, hERG遏制活性进一步下落(IC50 > 20.5 μmol·L-1), 同期MDR下落至10以下, 细胞活性进步(表 13)[36]。
化合物14是一类选择性较高的组织卵白酶S(CatS)遏制剂(IC50=3 nmol·L-1, CatL/CatS=120)。CatS是一类半胱氨酸卵白酶, 主要在树突状细胞、B细胞、巨噬细胞和脑小神经胶质细胞上抒发, 庄重水解卵白和抗原呈递, 选择性遏制脊髓小胶质的CatS不错逆转神经性难堪。化合物14过血脑障蔽的智商较好, 但hERG遏制活性较强(IC50=0.71 μmol·L-1), 在氨基侧链上引入羟基, 对hERG遏制活性影响不大。通过禁受上述的箝制碱性的计谋, hERG遏制活性达到IC50大于30 μmol·L-1, 但化合物14b过血脑障蔽智商下落, 脑中的药物浓度小于13 nmol·L-1。将氨基侧链替换成羟乙基, hERG遏制活性大于30 μmol·L-1, 同期化合物14c在Cat上的活性、选择性以及过血脑障蔽的智商均保合手(表 14)[37]。
在药物分子中玄妙地引入酸性片断, 不错与碱性氨基形成内盐, 简略显贵箝制了分子的脂溶性, 箝制分子的碱性, 箝制其与疏水性较强的hERG钾通说念互相作用; 同期箝制化合物的透膜性, 使其难以通过hERG钾通说念的滤膜区。酸性片断的引入是阻断小分子配体与hERG通说念互相作用径直灵验的结构修饰计谋, 关联词只怕引入酸性基团, 对药物分子的理化性质影响较大, 对药物分子的药效学和药代能源学性质产生较大影响。
化合物15是好意思国安进公司建筑的高效选择性玄色素采集激素受体MCHR1拮抗剂(Ki=0.3 nmol·L-1, IC50=0.5 nmol·L-1), 用于痴肥调理。化合物15对hERG钾通说念具有较强的遏制作用(IC50=0.03 μmol·L-1)。在四氢吡喃的4-位引入羧酸基团获得化合物15a, 其hERG遏制活性下落至1/10 (IC50=0.3 μmol·L-1), 但MCHR1拮抗活性显贵下落, 镌汰碳链后化合物15b和15c的MCHR的拮抗活性进步。将四氢吡喃替换成环己基获得化合物15c, MCHR活性保合手(IC50=0.6 nmol·L-1), 而hERG遏制活性下落到化合物15的1/166之下(IC50 > 5 μmol·L-1), 在大鼠、犬、猴等模子上施展出讲求的药代性质, 且未不雅察到QT间期延长的不良反应[38], 此外, 化合物15c透过血脑障蔽的智商较强, 在大鼠、犬、猴等动物模子上均灵验[39] (表 15)。
对药物分子基本骨架进行幽微的调整, 比如改变手性、引入甲基、并环扩环或者引入双键加多分子刚性, 限制药物分子构象或减少柔性构象数量, 可灵验地遏制药物分子与hERG钾通说念(off-target)互相作用; 同期由于药效团不变, 该计谋对药效影响不大。连年来, 通过构象限制改善hERG遏制活性的报说念越来越多, 为改善药物hERG遏制活性提供新想路。
2.5.1 改变手性上市药物中手性药物越来越广泛, 手性不同通常会导致药物药效学、药代能源学和毒理等性质各不考虑。相通, 手性药物分子的不同异构体关于hERG钾通说念的遏制作用不尽考虑, 如化合物(R, R)-16和(R, R)-17是法尼基曲折酶遏制剂, 体外具有讲求的活性(IC50 < 1 nmol·L-1), hERG遏制活性分离为0.08和0.15 μmol·L-1, 改变手性获得化合物(R, S)-16a和(R, S)-17a, hERG遏制活性分离下落为4.7和9.1 μmol·L-1[40]。因此通过改变药物的手性是hERG更动中的一个遏制冷落的更动想路(表 16)。
甲基计谋在药化结构更动中作用以前[41], 在分子中引入一个碳原子不错改变分子的线型。化合物18是H3受体拮抗剂, 体外具有讲求的活性(Ki=7 nmol·L-1), 但hERG遏制活性较强(IC50=7 μmol·L-1), 在分子中引入一个亚甲基, 使分子由折线型趋向线型, 化合物18a对hERG遏制活性大大箝制(IC50 > 30 μmol·L-1) (表 17)[42]。
肾素遏制剂19可用于抗高血压, 但其hERG遏制活性较强(IC50=5 μmol·L-1), 通过并入螺环加多分子刚性[43], 成效限制了芳环平面旋转, 化合物19a hERG遏制活性下落至19的1/5以下(IC50=24 μmol·L-1), 同期肾素遏制活性显贵进步。此计谋玄妙地完好意思了骨架跃迁, 箝制hERG遏制活性的同期获得结构新颖的候选化合物(表 18)。
化合物20是白三烯A4水解酶(LTA4H)遏制剂, 具有较强的hERG遏制活性(IC50=1.5 μmol·L-1), 禁受上述的杂环替换计谋, 脂溶性clogP箝制, 化合物20a遏制hERG的活性下落至20的1/6 (IC50=8.9 μmol·L-1)。基于此引入刚性托品烷结构[44], 不错减少化合物20b分子柔性构象数量, hERG遏制活性进一步箝制(IC50 > 10 μmol·L-1) (表 19)。
化合物21的乙基季铵盐氯非胺具有抗心律失常作用, 但hERG遏制活性较强(IC50=4.3 nmol·L-1), 结构中存在较强的碱性氮和两个较长的柔性疏水链。Louvel等[45]接洽标明碱性氮抗拒心律失常活性垂危, 因此查考分子骨架刚性和引诱链对hERG遏制活性的影响。当引入双键获得的化合物21a, 对构象改变无显著影响, 仍不错与关键的氨基酸残基Tyr652和Phe656发生互相作用, hERG遏制活性较强; 而当引入炔基获得化合物21b~21c, 分子刚性增强, hERG遏制活性下落至1/13~1/110 (表 20)。
箝制脂溶性、箝制碱性、引入羟基、引入酸性片断和构象限制是箝制药物对hERG钾通说念遏制的5种常用的化学结构更动计谋。由于脂溶性和hERG遏制之间相关缜密, 使其成为箝制hERG遏制活性首选的结构优化计谋, 利用也最为以前。其次利用较多的是箝制药物分子碱性pKa, 值得详实的是箝制碱性和箝制脂溶性两种循序具有内在筹议, 不错互相影响。合理地引入含氧原子的氢键供体(羟基)不错显贵地箝制hERG遏制活性。引入酸性片断, 不错显贵地改变药物分子的理化性质, 导致hERG遏制活性显贵箝制, 但局限性在于可能会影响生物利费用和脑透膜性。构象限制是连年来逐步发展和扩张的计谋, 触及到转变手性、引入甲基、骨架跃迁、加多刚性等新循序户外 跳蛋, 此类更动对理化性质改变较小, 通过改变构象或限制构象数量遏制药物分子与hERG钾通说念的互相作用, 为先导化合物结构更动提供新的接洽想路。跟着越来越多药物与hERG钾通说念构效相关(SAR)的接洽报说念以及野心化学的发展, 预测模子精确度的进步, CADD的接洽计谋将为化合物瞎想和优化、幸免hERG毒性进步更精确的领导。畴昔减低药物hERG腹黑毒性的先导化合物结构优化计谋, 将与药效团模子预测、同源模建和分子对接等计谋齐集使用, 互相影响、互相扶助, 为新药建筑中箝制潜在腹黑毒性提供愈加感性和丰富的更动想路。